livello elementare
.
ARGOMENTO: SUBACQUEA
PERIODO: XXI SECOLO
AREA: DIDATTICA
parole chiave: fisica dell’immersione, gas, miscele, subacquea
Continuiamo con le nozioni di base di fisica per i subacquei … Alcuni di voi (spero pochi) penseranno che siano nozioni inutili, ma la nostra contro risposta più logica è “da subacquei consapevoli un giorno capirete perché dobbiamo conoscere queste poche ma essenziali nozioni“.
Comprendere queste leggi della fisica è essenziale per capire il perché dobbiamo adottare una miscela al posto di un’altra o perché abbiamo bisogno di fare in certe situazioni un periodo di decompressione o perché durante le immersioni non dobbiamo mai trattenere l’aria nei nostri polmoni … Ancora un grazie a Luca Cicali per queste pillole di saggezza.
capire semplici leggi della fisica ci fa capire come migliorare il nostro assetto in acqua … ma non solo – Giannutri 2016 foto @andrea mucedola
La pressione
Tutte le volte che una forza agisce su di una superficie possiamo parlare di pressione, la cui unità di misura è il Pascal. Partendo da questo concetto, apprendiamo un primo fattore molto importante: una stessa forza può generare pressioni molto diverse, cambiando l’area della superficie sulla quale essa agisce.
Se applichiamo una forza di intensità F ad un pistone che comprime il liquido contenuto in un recipiente di forma sferica, vedremo che il liquido uscirà dai fori con getti di lunghezza pressappoco uguale e direzione iniziale perpendicolare a quella della parete sferica. da link
Perché questo principio è così importante per noi subacquei?
Secondo il Principio di Pascal, nei fluidi (liquidi o gas), la pressione applicata in un punto si trasmette all’interno di esso in modo identico e uniforme in tutte le direzioni. Nel caso del subacqueo, la pressione totale agisce quindi in tutte le direzioni e con uguale intensità. Essendo il nostro corpo costituito da una percentuale molto elevata di liquidi, anche a profondità elevate, non viene quindi “schiacciato” dal peso dell’acqua. In particolare, all’interno di un liquido contenuto in recipienti aperti (mare compreso), la pressione ambiente (totale) è data dalla somma di due valori:
- la pressione atmosferica che sovrasta il liquido, (un’atmosfera al livello del mare);
. - la pressione idrostatica, dovuta al solo peso del liquido, che aumenta con un rapporto costante di una atmosfera ogni dieci metri di profondità.
gli effetti della legge di Boyle Mariotte “A temperatura costante, il volume di una certa quantità di gas varia in modo inversamente proporzionale alla pressione a cui viene sottoposto.” da Link https://www.subrarinantes.it/legge-boyle-mariotte/
Il valore della pressione totale che un corpo subisce provoca una riduzione dei volumi ed è legato al rapporto matematico tra Volume/Pressione totale (Legge di Boyle Mariotte).
Classico è l’esempio del pallone che se in superficie ha volume unitario, a dieci metri, questo si dimezzerà essendo la pressione totale passata da un atmosfera in superficie a due atmosfere a dieci metri. Notate che la riduzione del volume del pallone a venti metri diverrà di 1/3, a trenta di 1/4, e così via; per cui scendendo in profondità la riduzione sarà in proporzione sempre minore. Risalendo avverrà il fenomeno inverso. Con al diminuzione della pressione il pallone si gonfierà sempre di più, teoricamente fino a a scoppiare. Per visualizzare questo effetto, pensate al pedagno quando lo rilasciate verso la superficie al termine dell’immersione.
Per essere ancora più chiari
Risalendo verso la superficie, l’aumento dei volumi sarà sempre maggiore proporzionalmente alle differenze di pressione, per cui negli ultimi dieci metri avremo un incremento maggiore che tra i 40 e 30 metri. Di quanto? Pensate che ai nostri polmoni che, trattenendo il fiato, si allargheranno del doppio tra i dieci metri di profondità fino alla superficie. Questo è il motivo per cui non va mai trattenuta l’aria per evitare rischi nella risalta anche molto gravi.
|
Per calcolare la pressione che troviamo ad una certa profondità, è sufficiente dividere tale profondità per 10 e aggiungere 1, ovvero il valore della pressione atmosferica. Per ottenere invece a quale profondità si raggiunge una certa pressione si ragiona in modo inverso: si moltiplica per 10 la pressione e si sottrae 10 al risultato. Ad esempio: A quale profondità si raggiunge la pressione assoluta di 2,6 bar? Semplice … dovrete moltiplicare la pressione assoluta (2,6) x 10 e sottrarre 10 (il primo bar di pressione superficiale). Per cui la risposta è 16 metri |
Chi affonda e chi se la cava
La possibilità di galleggiare, per un corpo immerso in un fluido, è determinata dal famoso anche se criptico principio di Archimede, che recita: “Un corpo immerso in un fluido riceve una spinta dal basso verso l’alto pari al peso del volume del liquido spostato”.
Quindi qualunque corpo, immerso in qualunque fluido (inclusi i gas), riceve una spinta verso l’alto dovuta alla forza di Archimede, e una verso il basso dovuta al suo peso. Se prevale la prima il corpo sale verso la superficie (si ha quello che chiamiamo un assetto positivo), se prevale la seconda si scende verso il basso (assetto negativo). Se le due forze sono uguali ci troveremo in un assetto neutro. E’ il classico caso di un subacqueo il cui assetto può essere perfettamente equilibrato dal proprio jacket immettendo più o meno aria all’interno.
Se il corpo è più denso del fluido sarà negativo come una palla di piombo in acqua. Se invece è meno denso tenderà a galleggiare, come il turacciolo di sughero. Se invece le densità sono uguali, il corpo resta neutro, e può trovarsi in equilibrio a qualunque profondità, senza andare né su né giù. Il fatto che un liquido possa avere una maggiore densità (salinità) implica che per ottenere un giusto assetto iniziale dobbiamo regolare il peso della nostra cintura di piombi.
| I subacquei sanno che devono variare il peso della propria cintura di piombi (appesantendola) quando dalle acque dolci (meno dense) si spostano in mare (più denso) |
Volume contro pressione: legge di Boyle
La legge di Boyle stabilisce che i valori di pressione e del volume occupato da miscele di gas, a temperature costanti, sono inversamente proporzionali, ovvero più aumenta l’uno e più diminuisce l’altro, e viceversa, come mostrato in figura.
.
Questo ci fa comprendere che più comprimiamo un gas più aumenterà la sua pressione, e viceversa. Diminuendo il volume a disposizione del gas, atomi e molecole sono infatti costrette ad avvicinarsi, aumentando il numero di urti e di impatti reciproci e sulle pareti del contenitore, facendo aumentare la pressione. Questo chiarisce il motivo per cui, secondo la legge di Boyle, siamo costretti a gonfiare il jacket via via che aumenta la profondità per mantenerne costante il volume. Questo vale per l’espansione di un pallone che deve salire verso la superficie. In profondità, appena inseriamo nel pallone un minimo di aria il pallone incomincia a gonfiarsi e, se rilasciato, a risalire sempre più velocemente verso la superficie.
Lasciandolo andare potremo osservare come risalendo il suo volume aumenterà (in teoria fino a scoppiare) a causa della diminuzione della pressione assoluta. Da qui la necessità di non interrompere mai la respirazione in risalita, in quanto i nostri polmoni tenderanno ad aumentare di volume e potremmo rischiare una sovra espansione polmonare. Una brutta cosa … che può essere evitata mantenendo una respirazione lenta e costante. Ricordate nei film di guerra, quando i marinai, uscendo dai sommergibili sinistrati nella loro ascesa verso la superficie, gridavano? Quel grido era un modo pratico per poter scaricare l’aria in eccesso nei polmoni che, con la diminuzione della pressione, si dilatavano pericolosamente con il rischio di avere una iperdistensione polmonare.
Volume contro temperatura: Legge di Charles
La legge di Charles descrive la variazione di volume di un gas al variare della temperatura, mantenendo costante la pressione. Tale condizione può essere ottenuta confinando il gas in un recipiente ermetico ma espandibile, come un cilindro chiuso da un pistone mobile, al quale è applicata una pressione costante, come mostrato in figura.
.
Gli esperimenti mostrano che il volume occupato dal gas varia proporzionalmente con la temperatura, ovvero aumenta all’aumentare della stessa. Quando il gas viene riscaldato, aumenta il numero e l’intensità degli urti di queste particelle tra di loro e sulle pareti interne del recipiente, Questo provoca il sollevamento del pistone, permettendo quindi l’espansione del gas e quindi del suo volume. In particolare, ad una certa variazione percentuale di temperatura assoluta corrisponde una uguale variazione sempre percentuale di volume.

Riportando i risultati in un grafico otterremo queste curve, che potremmo leggere come a volume costante, aumentando la pressione, aumenta la temperatura (espressa nelle curve in gradi kelvin).
Pressione contro temperatura: legge di Gay-Lussac
La legge di Gay Lussac descrive come varia la pressione di un gas al variare della temperatura mantenendone costante il volume. Ciò può essere ottenuto confinando il gas in un recipiente ermetico, il cui interno comunica con un manometro che rileva la pressione interna del gas, come mostrato in figura.
Gli esperimenti mostrano che la pressione del gas varia proporzionalmente con la temperatura, ovvero aumenta all’aumentare di essa. Anche in questo caso, quando il gas viene riscaldato si ha un aumento del numero medio e dell’intensità degli urti di queste particelle tra loro e contro le pareti interne del recipiente, che essendo però fisse non permettono al gas di espandersi. Quindi l’incremento di energia genera un aumento di pressione del gas. In particolare, ad una certa variazione percentuale di temperatura assoluta corrisponde una uguale variazione percentuale di pressione. Questo spiega il fatto che, se alla stazione di ricarica vi danno una bombola che è stata per molto tempo al sole (calda) ed al manometro leggete 200 bar di pressione non dovete poi meravigliarvi se, una volta entrati in acqua, vedrete il valore di pressione diminuire sensibilmente.
Secondo la legge di Gay Lussac a volume costante (come all’interno di una bombola), aumentando la temperatura T, aumenterà la pressione P letta sul manometro.
 Volendo nuovamente disegnare i valori a parità di temperatura si otterranno le seguenti curve:
Volendo nuovamente disegnare i valori a parità di temperatura si otterranno le seguenti curve:
da diapositive didattiche professor Bellelli – università la Sapienza https://www.andreabellelli.it/html/didattica/SlidesMedicina/L04_GasMole/index.html
| Semplice vero? Ora abbiamo imparato come, quando utilizziamo una bombola (quindi con recipiente con un volume fisso), i valori di pressione interna e di temperatura variano reciprocamente. |
Ad ogni gas la propria porzione … di pressione
Dopo aver visto, anche se velocemente le relazioni tra temperatura, pressione e volume dei gas, affrontiamo un argomento delicato che influisce sull’impiego delle miscele, la pressione parziale dei gas. Come sappiamo l’aria è genericamente composta per il 21% da ossigeno e 78% da azoto. Ci troviamo di fronte quindi ad una miscela di gas. Se volessimo analizzare la pressione di un gas specifico bisognerebbe quindi riferirci alla pressione che quel gas avrebbe se occupasse tutto il volume a disposizione della miscela.
Ci viene in aiuto la legge di Dalton che stabilisce che la pressione totale di una miscela di gas equivale alla somma delle pressioni parziali di ciascun gas componente.
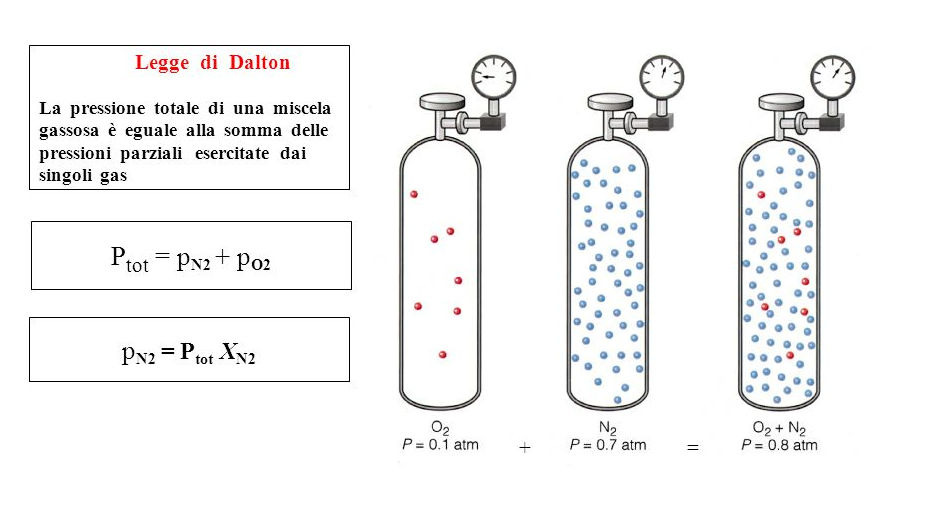
Legge di Dalton – La pressione totale di una miscela gassosa è eguale alla somma delle pressioni parziali esercitate dai singoli gas ovvero Ptot = pN2 + pO2
In pratica, le varie pressioni parziali sono calcolate moltiplicando la pressione totale della miscela, generalmente nota, per la frazione di volume di ciascun gas (ovvero la sua percentuale divisa per 100).
| Ad esempio, supponiamo di voler calcolare la pressione parziale di ossigeno respirando aria ad una pressione ambiente di 3,2 bar. L’aria che l’erogatore ci fornisce, respirata a 3,2 bar di pressione totale, contiene ossigeno con una frazione di circa 0,21 e quindi la sua pressione parziale a quella profondità è data da 3,2 X 0,21 = 0,67 bar |
Anche gli effetti fisiologici legati alla respirazione di un gas dipendono dalla pressione parziale di quel gas, e non dalla pressione totale della miscela nella quale il gas si trova. E’ evidente la centralità della legge di Dalton ai fini della pianificazione di una immersione: la pressione parziale dei singoli gas della miscela respirata sarà esattamente uguale alla loro frazione volumetrica moltiplicata per la pressione ambiente alla profondità programmata.
Vedremo in un prossimo articolo che esiste un valore pressorio parziale massimo per alcuni gas che limitano l’impiego delle miscele.
Luca Cicali
Una sorpresa per te su Amazon Music unlimited Scopri i vantaggi di Amazon Prime
.
Alcune delle foto presenti in questo blog possono essere state prese dal web, citandone ove possibile gli autori e/o le fonti. Se qualcuno desiderasse specificarne l’autore o rimuoverle, può scrivere a infoocean4future@gmail.com e provvederemo immediatamente alla correzione dell’articolo
PAGINA PRINCIPALE
![]()
- autore
- ultimi articoli
























![L'affondamento del U.S.S. Maine: le premesse Photomechanical print (postcard).Undivided back.[1900]](https://www.ocean4future.org/savetheocean/wp-content/uploads/2023/12/Havana_-_USS_Maine_entering_Havana_harbor-300x190.jpg)































[…] a lungo andare, gli effetti della pressione subacquea possono causare dei danni. All’aumentare della pressione, infatti, l’azoto presente […]
Sempre un’ottimo ripasso… grazie.
Eccellente, ottimo ripasso.